Передается ли порок сердца по наследству плоду? Что показывает и дает УЗИ сердца: выявляет ли исследование врожденные пороки, пролапс митрального клапана
Одной из наиболее часто диагностируемых аномалий развития сердечно-сосудистой системы у детей считается врожденный порок сердца. Такое анатомическое нарушение структуры сердечной мышцы, возникающее в период внутриутробного развития плода, грозит серьезными последствиями для здоровья и жизни ребенка. Избежать трагического исхода вследствие ВПС у детей может помочь своевременное медицинское вмешательство.
Задача родителей – ориентироваться в этиологии недуга и знать об основных его проявлениях. В силу физиологических особенностей новорожденных некоторые патологии сердца сложно диагностировать сразу после появления малыша на свет. Поэтому нужно внимательно следить за состоянием здоровья растущего ребенка, реагировать на любые изменения.
Классификация врожденных пороков сердца у детей
Врожденный порок сердца провоцирует нарушение кровотока по сосудам или в сердечной мышце.
Чем раньше врожденный порок сердца будет выявлен, тем благоприятнее прогнозы и исход лечения заболевания.
В зависимости от внешних проявлений патологии выделяют следующие типы ВПС:
- «Белые» (или «бледные») пороки
Такие пороки тяжело диагностировать из-за отсутствия явных симптомов. Характерное изменение – бледность кожных покровов у ребенка. Это может сигнализировать о поступлении недостаточного количества артериальной крови в ткани.
- «Синие» пороки
 Основное проявление данной категории патологии – посинение кожных покровов, особенно заметное в области ушей, губ и пальцев. Такие изменения вызывает гипоксия тканей, спровоцированная смешиванием артериальной и венозной крови.
Основное проявление данной категории патологии – посинение кожных покровов, особенно заметное в области ушей, губ и пальцев. Такие изменения вызывает гипоксия тканей, спровоцированная смешиванием артериальной и венозной крови.
К группе «синих» пороков относят транспозицию аорты и легочной артерии, аномалию Эбштейна (смещенное место прикрепления створок трехстворчатого клапана к полости правого желудочка), тетраду Фалло (так называемую «синюшную болезнь», комбинированный дефект, сочетающий четыре патологии – стеноз выходного отдела правого желудочка, декстрапозицию аорты, высокий и гипертрофию правого желудочка).
Учитывая характер нарушения кровообращения, врожденные пороки сердца у детей классифицируют на такие типы:
- Сообщение со сбросом крови слева направо (открытый артериальный проток, дефект межжелудочковой или межпредсердной перегородки).
- Сообщение со сбросом крови справа налево (атрезия трехстворчатого клапана).
- Пороки сердца без сброса крови (стеноз или коарктация аорты, стеноз легочной артерии).
В зависимости от сложности нарушения анатомии сердечной мышцы выделяют такие врожденные пороки сердца в детском возрасте:
- простые пороки (одиночные дефекты);
- сложные (сочетание двух патологических изменений, к примеру, сужение сердечных отверстий и клапанная недостаточность);
- комбинированные пороки (сложные для лечения комбинации множественных аномалий).
Причины возникновения патологии
Нарушение дифференцировки сердца и появление ВПС у плода провоцирует воздействие неблагоприятных факторов окружающей среды на женщину в период вынашивания ребенка.
К основным причинам, способным вызвать сердечные аномалии у детей в период их внутриутробного развития, относятся:
- генетические нарушения (мутация хромосом);
- курение, употребление алкоголя, наркотических и токсических веществ женщиной в период вынашивания ребенка;
- перенесенные во время беременности инфекционные болезни (вирус краснухи и гриппа, ветрянка, гепатит, энтеровирус и др.);
- неблагоприятные экологические условия (повышенный радиационный фон, высокий уровень загрязнения воздуха и т. д.);
- употребление лекарств, прием которых запрещен в период беременности (также препаратов, чье влияние и побочные эффекты не достаточно исследованы);
- наследственные факторы;
- соматические патологии матери (в первую очередь сахарный диабет).
Это основные факторы, провоцирующие возникновение порока сердца у детей в период их внутриутробного развития. Но существуют и группы риска – это дети, рожденные женщинами старше 35 лет, а также страдающими эндокринными дисфункциями или токсикозом I триместра.
Симптомы ВПС
Уже в первые часы жизни детский организм может сигнализировать об аномалиях развития сердечно-сосудистой системы. Аритмия, учащенное сердцебиение, затруднение дыхания, потеря сознания, слабость, синюшные или бледные кожные покровы свидетельствуют о возможных патологиях сердца.
Но симптомы ВПС могут проявиться и значительно позже. Беспокойство родителей и немедленное обращение за медицинской помощью должны вызвать такие изменения в состоянии здоровья ребенка:
- посинение или нездоровая бледность кожи в области носогубного треугольника, стоп, пальцев, ушей и лица;
- трудности с кормлением ребенка, плохой аппетит;
- отставание в увеличении веса и роста у малыша;
- отеки конечностей;
- повышенная утомляемость и сонливость;
- обмороки;
- повышенное потоотделение;
- одышка (постоянно затрудненное дыхание или временные приступы);
- независимое от эмоциональных и физических нагрузок изменение сердечного ритма;
- шумы в сердце (определяются при прослушивании врачом);
- боли в области сердца, грудной клетки.
В некоторых случаях пороки сердца у детей протекают бессимптомно. Это усложняет выявление недуга на ранних его стадиях.
 Предотвратить усугубление болезни и развитие осложнений поможет регулярное посещение педиатра. Врач при каждом плановом осмотре обязательно выслушивает звучание тонов сердца ребенка, проверяя наличие или отсутствие шумов – неспецифических изменений, которые зачастую носят функциональный характер и не несут опасности для жизни. До 50% выявленных при педиатрическом осмотре шумов могут сопровождать «малые» пороки, не требующие хирургического вмешательства. В этом случае рекомендуют регулярное посещение, наблюдение и консультации детского кардиолога.
Предотвратить усугубление болезни и развитие осложнений поможет регулярное посещение педиатра. Врач при каждом плановом осмотре обязательно выслушивает звучание тонов сердца ребенка, проверяя наличие или отсутствие шумов – неспецифических изменений, которые зачастую носят функциональный характер и не несут опасности для жизни. До 50% выявленных при педиатрическом осмотре шумов могут сопровождать «малые» пороки, не требующие хирургического вмешательства. В этом случае рекомендуют регулярное посещение, наблюдение и консультации детского кардиолога.
Если врач сомневается в происхождении таких шумов или наблюдает патологические изменения звука, ребенка обязательно направляют на кардиологическое обследование. Детский кардиолог повторно выслушивает сердце и назначает дополнительные диагностические исследования для того, чтобы подтвердить или опровергнуть предварительный диагноз.
Проявления недуга в разной степени сложности встречаются не только у новорожденных детей. Пороки могут впервые дать о себе знать уже в подростковом возрасте. Если у ребенка, внешне выглядящего абсолютно здоровым и активным, появляются признаки отставания в развитии, наблюдается посинение или болезненная бледность кожи, одышка и усталость даже от небольших нагрузок, то необходим осмотр педиатра и консультация кардиолога.
Способы диагностики
Чтобы изучить состояние сердечной мышцы и клапанов, а также выявить аномалии кровообращения, врачи используют такие способы :
- Эхокардиография – ультразвуковое исследование, позволяющее получить данные о патологиях сердца и его внутренней гемодинамике.
- Электрокардиограмма – диагностика нарушений сердечного ритма.
- Фонокардиография – отображение тонов сердца в виде графиков, позволяющих изучить все нюансы, недоступные при выслушивании ухом.
- с допплером – методика, позволяющая врачу визуально оценить процессы кровотока, состояние сердечных клапанов и коронарных сосудов с помощью прикрепления специальных датчиков в области грудной клетки пациента.
- Кардиоритмография – исследование характеристик структуры и функций сердечно-сосудистой системы, её вегетативной регуляции.
- Катетеризация сердца – ввод катетера в правый или левый отделы сердца для определения давления в полостях. Во время этого обследования проводится и вентрикулография – рентгенологическое исследование камер сердца с введением контрастных веществ.
Каждый из этих методов не применяется врачом изолированно – для точного диагностирования патологии сравниваются результаты разных исследований, позволяющих установить основные нарушения гемодинамики.
 На основе полученных данных кардиолог определяет анатомический вариант аномалии, уточняет фазу течения, и прогнозируется вероятные осложнения порока сердца у ребенка.
На основе полученных данных кардиолог определяет анатомический вариант аномалии, уточняет фазу течения, и прогнозируется вероятные осложнения порока сердца у ребенка.
Если в роду кого-либо из будущих родителей имели место пороки сердца, организм женщины в период вынашивания ребенка подвергался, хотя бы одному из опасных факторов или будущий ребенок находиться в группе риска возможного развития ВПС, то беременная должна предупредить об этом наблюдающего её акушера-гинеколога.
Врач, учитывая такую информацию, должен особое внимание обратить на наличие признаков сердечных аномалий у плода, применить все возможные меры диагностики недуга в дородовом периоде. Задача будущей мамы – своевременно проходить УЗИ и другие назначенные доктором обследования.
Лучшие результаты с точными данными о состоянии сердечно-сосудистой системы дает новейшее оборудование для диагностики детских пороков сердца.
Лечение врожденного порока сердца у детей
Врожденные аномалии сердца в детском возрасте лечат двумя способами:
- Хирургическое вмешательство.
- Терапевтические процедуры.
![]() В большинстве случаев единственным возможным шансом спасти жизнь ребенка является именно первый радикальный способ. Обследование плода на наличие патологий сердечно-сосудистой системы проводят еще до его появления на свет, поэтому чаще всего вопрос о назначении операции решается именно в этот период.
В большинстве случаев единственным возможным шансом спасти жизнь ребенка является именно первый радикальный способ. Обследование плода на наличие патологий сердечно-сосудистой системы проводят еще до его появления на свет, поэтому чаще всего вопрос о назначении операции решается именно в этот период.
Роды в таком случае проводят в специализированных родильных отделениях, функционирующих при кардиохирургических больницах. Если операция не проведена сразу после рождения ребенка, хирургическое лечение назначают в максимально короткие сроки, желательно на первом году жизни. Такие меры продиктованы необходимостью обезопасить организм от развития возможных опасных для жизни последствий ВПС – сердечной недостаточности и .
Современная кардиохирургия предполагает проведение операций на открытом сердце, а также с помощью метода катетеризации, дополненного рентгеновской визуализацией и чреспищеводной эхокардиографией. Устранение дефектов сердечных пороков эффективно проводится с помощью баллонной пластики, эндоваскулярного лечения (методы введения стенов и герметизирующих инструментов). В комплексе с хирургическим вмешательством пациенту назначают лекарственные препараты, повышающие эффективность лечения.
Терапевтические процедуры являются вспомогательным методом борьбы с недугом и применяются при возможности или необходимости перенесения операции на более поздние сроки. Терапевтическое лечение часто рекомендуют при «бледных» пороках, если болезнь не развивается стремительно в течение месяцев и лет, не угрожает жизни ребенка.
В подростковом возрасте могут развиваться приобретенные пороки сердца у детей – комбинации из исправленных дефектов и вновь возникающих аномалий. Поэтому ребенку, который подвергался хирургической коррекции патологии, позже может понадобиться повторное оперативное вмешательство. Такие операции чаще всего проводятся щадящим малоинвазивным методом, чтобы исключить нагрузку на психику и организм ребенка в целом, а также избежать шрамов.
При лечении сложных пороков сердца врачи не ограничиваются коррекционными методами. Чтобы стабилизировать состояние ребенка, устранить угрозу жизни и максимально повысить её продолжительность для пациента требуется проведение целого ряда пошаговых оперативных вмешательств с обеспечением полноценного кровоснабжения организма и легких в частности.
Своевременное выявление и лечение врожденных и сердца у детей дает возможность большинству маленьких пациентов полноценно развиваться, вести активный образ жизни, поддерживать здоровое состояние организма и не чувствовать себя ущемленным в моральном или физическом плане.
Даже после успешного хирургического вмешательства и самых благоприятных врачебных прогнозов основная задача родителей – обеспечить ребенку регулярные посещения и осмотры детского кардиолога.
Врожденный порок сердца (ВПС) - это анатомические изменения сердца, его сосудов и клапанов, развивающиеся внутриутробно. По статистике, подобная патология встречается у 0,8-1,2 % всех новорожденных. ВПС у ребенка - одна из самых частых причин смерти в возрасте до 1 года.
Причины ВПС у детей
В настоящий момент не существует однозначных объяснений возникновения тех или иных пороков сердца. Известно лишь, что наиболее уязвим самый важный орган плода на сроке от 2 до 7 недель беременности. Именно в это время происходит закладка всех основных частей сердца, образование его клапанов и крупных сосудов. Любое воздействие, произошедшее в этот период, может привести к формированию патологии. Как правило, выяснить точную причину не удается. Чаще всего к развитию ВПС приводят следующие факторы:
- генетические мутации;
- вирусные инфекции, перенесенные женщиной во время беременности (в частности, краснуха);
- тяжелые экстрагенитальные заболевания матери (сахарный диабет, системная красная волчанка и другие);
- злоупотребление алкоголем во время беременности;
- возраст матери старше 35 лет.
На формирование ВПС у ребенка также могут влиять неблагоприятная экологическая обстановка, радиационное облучение и прием некоторых лекарственных препаратов во время беременности. Риск рождения малыша с подобной патологией возрастает в том случае, если у женщины уже отмечались регрессирующие беременности в прошлом, мертворождение или гибель младенца в первые дни жизни. Не исключено, что причиной этих проблем стали недиагностированные пороки сердца.
Не стоит забывать и о том, что ВПС может быть не самостоятельной патологией, а частью какого-то не менее грозного состояния. Например, при заболевания сердца встречаются в 40 % случаев. При рождении ребенка с множественными пороками развития самый главный орган чаще всего также будет вовлечен в патологический процесс.
Виды ВПС у детей
Медицине известно более 100 видов различных пороков сердца. Каждая научная школа предлагает свою классификацию, но чаще всего ВПС разделяются на «синие» и «белые». Такое выделение пороков основано на внешних признаках, их сопровождающих, а точнее, на интенсивности окраски кожных покровов. При «синих» у ребенка отмечается цианоз, а при «белых» кожа становится очень бледной. Первый вариант встречается при тетраде Фалло, атрезии легочной артерии и других заболеваниях. Второй тип больше характерен для дефектов межпредсердной и межжелудочковой перегородок.
Существует и другой способ разделения ВПС у детей. Классификация в данном случае предполагает объединение пороков в группы по состоянию легочного кровообращения. Здесь выделяют три варианта:
1. ВПС с перегрузкой малого круга кровообращения:
- открытый артериальный проток;
- дефект межпредсердной перегородки (ДМПП);
- дефект межжелудочковой перегородки (ДМЖП);
2. ВПС с обеднением малого круга:
- тетрада Фалло;
- стеноз легочной артерии;
- транспозиция магистральных сосудов.
3. ВПС с неизмененным кровотоком в малом круге:
- коарктация аорты;
- стеноз аорты.
Признаки врожденных пороков сердца у детей
Диагноз "ВПС" у ребенка ставится на основании целого ряда симптомов. В тяжелых случаях изменения будут заметны сразу после рождения. Опытному доктору не составит труда поставить предварительный диагноз уже в родильном зале и скоординировать свои действия в соответствии со сложившейся ситуацией. В других случаях о наличии порока сердца родители не подозревают еще много лет, пока болезнь не перейдет в стадию декомпенсации. Многие патологии выявляются лишь в подростковом возрасте на одном из регулярных медицинских осмотров. У молодых людей ВПС нередко диагностируются при прохождении комиссии в военкомате.
Что же дает доктору основание предположить ВПС у ребенка еще в родильном зале? Прежде всего обращает на себя внимание нетипичная окраска кожи новорожденного. В отличие от розовощеких малышей ребенок с пороком сердца будет бледным или синим (в зависимости от вида поражения легочного круга кровообращения). Кожа прохладная и сухая на ощупь. Цианоз может распространяться на все тело или же ограничиваться носогубным треугольником в зависимости от тяжести порока.
При первом же выслушивании тонов сердца доктор заметит патологические шумы в значимых точках аускультации. Причиной появления таких изменений служит неправильный ток крови по сосудам. В этом случае с помощью фонендоскопа врач услышит усиление или ослабление сердечных тонов или же обнаружит нетипичные шумы, которых не должно быть у здорового ребенка. Все это в комплексе дает возможность неонатологу заподозрить наличие врожденного порока сердца и направить малыша на прицельную диагностику.
Новорожденный с тем или иным ВПС, как правило, ведет себя беспокойно, часто и беспричинно плачет. Некоторые дети, напротив, оказываются слишком вялыми. Они не берут грудь, отказываются от бутылочки и плохо спят. Не исключено появление одышки и тахикардии (учащенного сердцебиения)
В том случае, если диагноз ВПС у ребенка был поставлен в более позднем возрасте, возможно развитие отклонений в умственном и физическом развитии. Такие дети медленно растут, плохо набирают в весе, отстают в учебе, не поспевая за здоровыми и активными сверстниками. Они не справляются с нагрузками в школе, не блещут на уроках физкультуры, часто болеют. В некоторых случаях порок сердца становится случайной находкой на очередном из медицинских осмотров.
В тяжелых ситуациях развивается хроническая сердечная недостаточность. Появляется одышка при малейшей нагрузке. Отекают ноги, увеличивается печень и селезенка, происходят изменения в малом круге кровообращения. При отсутствии квалифицированной помощи это состояние заканчивается инвалидизацией или даже смертью ребенка.
Все эти признаки позволяют в большей или меньшей степени подтвердить наличие ВПС у детей. Симптомы могут варьировать в разных случаях. Применение современных методов диагностики позволяет подтвердить заболевание и вовремя назначить необходимое лечение.
Стадии развития ВПС
Вне зависимости от типа и степени тяжести все пороки проходят несколько этапов. Первая стадия называется адаптационной. В это время организм ребенка приспосабливается к новым условиям существования, подгоняя работу всех органов под несколько измененное сердце. За счет того, что всем системам приходится в это время работать на износ, не исключено развитие острой сердечной недостаточности и сбой в работе всего организма.
Вторая стадия - фаза относительной компенсации. Изменившиеся структуры сердца обеспечивают ребенку более или менее нормальное существование, выполняя все свои функции на должном уровне. Эта стадия может длиться годами, пока не приведет к отказу всех систем организма и развитию декомпенсации. Третья фаза ВПС у ребенка называется терминальной и характеризуется серьезными изменениями во всем теле. Сердце больше не может справляться со своей функцией. Развиваются дегенеративные изменения в миокарде, рано или поздно заканчивающиеся летальным исходом.
Дефект межпредсердной перегородки
Рассмотрим один из видов ВПС. ДМПП у детей - это один из наиболее частых пороков сердца, обнаруживающийся у малышей в возрасте старше трех лет. При этой патологии у ребенка имеется небольшое отверстие между правым и левым предсердиями. В результате идет постоянный заброс крови слева направо, что закономерно приводит к переполнению легочного круга кровообращения. Все симптомы, развивающиеся при этой патологии, связаны с нарушением нормального функционирования сердца в измененных условиях.

В норме отверстие между предсердиями существует у плода до самого рождения. Оно называется овальным окном и, как правило, закрывается с первым вдохом новорожденного. В некоторых случаях отверстие остается открытым на всю жизнь, но этот дефект столь мал, что человек даже не знает об этом. Нарушений гемодинамики при таком варианте не отмечается. не причиняющее ребенку никакого дискомфорта, может стать случайной находкой во время ультразвукового исследования сердца.
В противоположность этому истинный дефект межпредсердной перегородки представляет собой более серьезную проблему. Такие отверстия имеют большие размеры и могут располагаться как в центральной части предсердий, так и по краям. Вид ВПС (ДМПП у детей, как мы уже говорили, встречается наиболее часто) будет определять метод лечения, выбранный специалистом на основании данных УЗИ и других методов обследования.
Симптомы ДМПП
Выделяют первичный и вторичный дефекты межпредсердной перегородки. Различаются они между собой особенностями расположения отверстия в стенке сердца. При первичном ДМПП дефект обнаруживается в нижней части перегородки. Диагноз "ВПС, вторичный ДМПП" у детей выставляется в том случае, когда отверстие расположено ближе к центральной части. Такой порок гораздо легче поддается коррекции, ведь в нижнем отделе перегородки остается немного сердечной ткани, позволяющей закрыть дефект полностью.
В большинстве случаев дети раннего возраста с ДМПП ничем не отличаются от своих сверстников. Они растут и развиваются в соответствии с возрастом. Отмечается склонность к частым простудным заболеваниям без особого повода. Из-за постоянного заброса крови слева направо и переполнения малого круга кровообращения малыши подвержены бронхолегочным заболеваниям, в том числе тяжелым пневмониям.

В течение многих лет жизни у детей с ДМПП может отмечаться лишь небольшой цианоз в области носогубного треугольника. Со временем развивается бледность кожи, одышка при незначительных физических нагрузках, влажный кашель. При отсутствии лечения ребенок начинает отставать в физическом развитии, перестает справляться с обычной школьной программой.
Сердце маленьких пациентов довольно долго выдерживает повышенную нагрузку. Жалобы на тахикардию и перебои сердечного ритма обычно появляются в возрасте 12-15 лет. Если ребенок не находился под наблюдением врачей и ему ни разу не проводилось ЭхоКГ, диагноз "ВПС, ДМПП" у ребенка может быть выставлен только в подростковом возрасте.
Диагностика и лечение ДМПП
При осмотре кардиолог отмечает усиление сердечных шумов в значимых точках аускультации. Это связано с тем, что при прохождении крови через суженные клапаны развиваются завихрения, которые доктор слышит через стетоскоп. Кровоток через дефект в перегородке каких-либо шумов не вызывает.
Во время прослушивания легких можно обнаружить влажные хрипы, связанные с застоем крови в малом круге кровообращения. При перкуссии (простукивании грудной клетки) выявляется увеличение границ сердца в связи с его гипертрофией.
При обследовании на электрокардиограмме отчетливо видны признаки перегрузки правых отделов сердца. На ЭхоКГ обнаруживается дефект в области межпредсердной перегородки. Рентгеновский снимок легких позволяет увидеть симптомы застоя крови в легочных венах.
В отличие от дефекта межжелудочковой перегородки ДМПП никогда не закрывается самостоятельно. Единственным методом лечения такого порока является хирургический. Операция проводится в возрасте 3-6 лет, пока не развилась декомпенсация сердечной деятельности. Хирургическое вмешательство плановое. Операцию выполняют на открытом сердце в условиях искусственного кровообращения. Доктор делает ушивание дефекта или же, если отверстие слишком большое, закрывает его заплатой, выкроенной из перикарда (сердечной сорочки). Стоит отметить, что операция при ДМПП была одним из первых хирургических вмешательств на сердце более 50 лет назад.
В некоторых случаях вместо традиционного ушивания используется эндоваскулярный метод. В этом случае в бедренной вене делается прокол, и через него в полость сердца вводится окклюдер (специальное устройство, с помощью которого закрывается дефект). Этот вариант считается менее травматичным и более безопасным, поскольку выполняется без вскрытия грудной клетки. После такой операции дети гораздо быстрее восстанавливаются. К сожалению, не во всех случаях можно применить эндоваскулярный метод. Иногда расположение отверстия, возраст ребенка, а также другие сопутствующие факторы не позволяют провести подобное вмешательство.
Дефект межжелудочковой перегородки
Поговорим еще об одном виде ВПС. ДМЖП у детей - второй из самых часто встречающихся пороков сердца в возрасте старше трех лет. В этом случае обнаруживается отверстие в перегородке, разделяющей правый и левый желудочки. Происходит постоянный заброс крови слева направо, и, как и в случае с ДМПП, развивается перегрузка малого круга кровообращения.
Состояние маленьких пациентов может сильно отличаться в зависимости от размеров дефекта. При небольшом отверстии ребенок может не предъявлять никаких жалоб, и шум при аускультации - единственный момент, который будет беспокоить родителей. В 70 % случаев незначительные дефекты межжелудочковой перегородки закрываются сами собой в возрасте до 5 лет.

Совсем другая картина вырисовывается при более тяжелом варианте ВПС. ДМЖП у детей иногда достигает больших размеров. В этом случае велика вероятность развития легочной гипертензии - грозного осложнения данного порока. Поначалу все системы организма приспосабливаются к новым условиям, перегоняя кровь из одного желудочка в другой и создавая повышенное давление в сосудах малого круга. Рано или поздно развивается декомпенсация, при которой сердце больше не может справляться со своей функцией. Сброса венозной крови не происходит, она накапливается в желудочке и попадает в большой круг кровообращения. Высокое давление в легких не позволяет провести операцию на сердце, и такие пациенты часто умирают от осложнений. Вот почему так важно вовремя выявить этот порок и направить ребенка на хирургическое лечение.
В том случае, когда ДМЖП не закрылся самостоятельно до 3-5 лет или же имеет слишком большие размеры, проводится операция по восстановлению целостности межжелудочковой перегородки. Как и в случае с ДМПП, отверстие ушивается или же закрывается заплатой, выкроенной из перикарда. Можно закрыть дефект и эндоваскулярным путем, если условия позволяют это сделать.
Лечение врожденных пороков сердца
Хирургический метод является единственным для устранения подобной патологии в любом возрасте. В зависимости от тяжести лечение ВПС у детей может быть выполнено как в так и в более старшем возрасте. Известны случаи проведения операции на сердце у плода в утробе матери. При этом женщины смогли не только благополучно доносить беременность до положенного срока, но и родить относительно здорового ребенка, которому не требуется реанимация в первые же часы жизни.

Виды и сроки лечения в каждом случае определяются индивидуально. Кардиохирург, основываясь на данных осмотра и инструментальных методов обследования, выбирает способ операции и назначает сроки. Все это время ребенок находится под наблюдением специалистов, контролирующих его состояние. В ходе подготовки к операции малыш получает необходимую медикаментозную терапию, позволяющую максимально устранить неприятные симптомы.
Инвалидность при ВПС у ребенка при условии своевременного лечения развивается довольно редко. В большинстве случаев хирургическая операция позволяет не только избежать летального исхода, но и создать нормальные условия жизни без существенных ограничений.
Профилактика врожденных пороков сердца
К сожалению, уровень развития медицины не представляет возможности вмешаться во и как-то повлиять на закладку сердца. Профилактика ВПС у детей предполагает тщательное обследование родителей перед планируемой беременностью. Будущей маме перед зачатием ребенка также следует отказаться от вредных привычек, сменить работу на вредном производстве на другую деятельность. Подобные меры позволят снизить риски рождения ребенка с патологией развития сердечно-сосудистой системы.
Плановая вакцинация против краснухи, которая проводится всем девочкам, позволяет избежать появления ВПС вследствие этой опасной инфекции. Кроме того, будущим мамам обязательно следует пройти ультразвуковой скрининг в положенные сроки гестации. Этот метод позволяет вовремя выявить пороки развития у малыша и принять необходимые меры. Рождение такого ребенка будет проходить под присмотром опытным кардиологов и хирургов. При необходимости сразу из родильного зала новорожденного заберут в специализированное отделение, чтобы тут же прооперировать и дать ему возможность жить дальше.
Прогноз при сердца зависит от многих факторов. Чем раньше будет выявлено заболевание, тем больше шансов не допустить состояния декомпенсации. Своевременно проведенное хирургическое лечение не только спасает жизни маленьких пациентов, но и позволяет им жить без каких-либо существенных ограничений по состоянию здоровья.
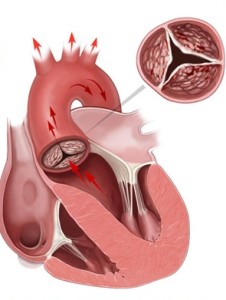
Эхокардиография (УЗИ сердца) – способ обследования органа, показывающий имеющиеся ухудшения и отклонения. УЗИ абсолютно неопасная и несложная процедура, с помощью которой обнаруживаются такие заболевания, как легочная гипертензия, врожденные пороки у детей, пороки митрального клапана, пролапс и прочие нарушения.
Сердце по строению можно разделить на четыре отдела (камеры): левое и правое предсердие и левый и правый желудочек. Межпредсердная перегородка разделяет оба предсердия, межжелудочковая перегородка – желудочки. Назначение этих перегородок в том, чтобы не смешивались виды крови. Трехстворчатый клапан соединяет правое предсердие и правый желудочек. Они перемещают в легкие кровь из вен. Левое предсердие и левый желудочек объединяет митральный клапан. С их помощью артериальная кровь распространяется по всему организму, и они не дают крови вернуться обратно в сердце.
Сердце человека делится на четыре камеры: левое и правое предсердие и левый и правый желудочек, отделенные друг от друга. Это разделение необходимо для того, чтобы венозная и артериальная кровь не смешивались друг с другом
Для чего проводится обследование?
Эхокардиография (УЗИ сердца) считается несложной процедурой диагностики, которая помогает обнаружить определенные болезни до возникновения их проявлений. Обычно, эхокардиография назначается страдающим одышкой, головокружениями, вялостью, обмороками, возникновением приступов тахикардии, нарушениями, мешающими сердечной активности, болевыми ощущениями в органе.
Если были обнаружены шумы в сердце, имеются подозрения на вредные для сердечно-сосудистой системы заболевания (например, ревматизм) и заболевания легких в хронической форме, присутствует гипертоническая болезнь, а электрокардиография указывает на нарушения в сердечной активности, то назначение на обследование обязательно. Также назначается детям для подтверждения порока сердца при рождении.
Большая часть новейших аппаратов УЗИ проводит не только ультразвуковое исследование сердечно-сосудистой системы, но способно делать и допплерографию, которая заключается в прослеживании движения крови в сердечных камерах. Помогает наблюдать работу органа и определять недостатки в развитии клапанов.
Нормы эхокардиографии сердца
Эхокардиография позволяет выявить ряд отклонений в деятельности сердечной мышцы. Только специалист может провести анализ, сделать заключение. Следующие параметры являются нормой при проведении эхокардиографии:
- диаметр аорты - до 3,7 см;
- раскрытие створок аортального клапана - 1,5 см. и более;
- размер левого предсердия - до 4 см;
- конечный диастолический размер левого желудочка - до 5,5 см;
- конечный систолический размер левого желудочка - до 4,1 см;
- толщина межжелудочковой перегородки - до 1,1 см;
- толщина задней стенки левого желудочка - до 1,1 см;
- фракция выброса - не менее 60%;
- фракция укорочения - 30-40%;
- площадь открытия митрального клапана - 4 см.2;
- размер полости правого желудочка - до 3 см.
Проводя эхокардиографию, врач изучает размер камер, толщину стенок, контуры и активность клапанов, деятельность миокарда (мышечного слоя). Ухудшение тех или иных показателей говорит о разнообразных нарушениях сердечно-сосудистой системы.
 На УЗИ сердца (эхокардиографии) врач может увидеть строение органа, толщину и функциональность стенок камер, отследить расположение и величину клапанов. Все эти данные обладают высокой информативностью при постановке диагноза
На УЗИ сердца (эхокардиографии) врач может увидеть строение органа, толщину и функциональность стенок камер, отследить расположение и величину клапанов. Все эти данные обладают высокой информативностью при постановке диагноза Легочная гипертензия на УЗИ
Легочная гипертензия – нарастающее увеличение давления в легочной артерии. Различается врожденная и приобретенная гипертензия. Эхокардиография дает максимальное количество информации для определения давления в артерии, чтобы поставить диагноз «легочная гипертензия». Обнаруженные на М-режиме такие показатели, как торможение раскрытия клапана артерии, его закрытие во время систолы и увеличение продолжительности выброса правого желудочка по отношению к общей продолжительности выброса, указывают на гипертензию легких.
Двухмерное УЗИ может показать гипертрофию правого желудочка. Если его стенка более 10 мм., то следует вывод о чрезмерной гипертрофии, которая наблюдается при хроническом легочном сердце. В понятие нормы (отсутствие гипертензии) укладывается значение менее 4 мм., в то время как острая легочная гипертензия дает 6-8 мм. толщины стенки. Двухмерное исследование при гипертензии также обнаруживает гибкость межжелудочковой перегородки. Легочная гипертензия в выраженной форме вызывает парадоксальное систолическое движение, которое, сочетаясь со сниженным легочным потоком, влечет к ухудшению изометрического расслабления левого желудочка.
Дополнительные симптомы гипертензии:
- сброс крови справа налево по открытому артериальному протоку;
- сброс крови справа налево по овальному окну;
- легочная артерия с давлением больше 40 мм. рт. ст., больше 50% от общего давления.
Врожденные пороки сердца на исследовании у детей
Врожденные пороки сердца – нарушения в анатомии органа, являющиеся внутриутробной патологией. Нередко такая патология бывает вызвана негативными влияниями на находящийся в утробе эмбрион. Существует несколько разновидностей этого заболевания.
 Порок сердца - аномалия, которая развивается внутриутробно. Чаще всего она связана с генетической предрасположенностью или негативным внешним влиянием на плод
Порок сердца - аномалия, которая развивается внутриутробно. Чаще всего она связана с генетической предрасположенностью или негативным внешним влиянием на плод Открытый артериальный проток – канал, устанавливающий связь между легочной артерией и аортой. В период внутриутробного развития активно обеспечивает плод кислородом, не используя для этой цели легкие. Зарастает через 2-8 недель после рождения. Если этого не произошло, считается пороком. Врожденная патология у детей может не иметь никаких симптомов, но иногда заболевание обнаруживается в виде задержки в росте, потемнения кожи, частых воспалений легких. При обследовании УЗИ можно заметить увеличение стенки предсердия и желудочка сердца, поражённого пороком, а допплерография покажет, присутствует ли сброс крови из аорты в легочную артерию, что также является показателем патологии.
Дефект межжелудочковой перегородки – патология, когда перепонка имеет врожденную щель между правым и левым желудочком. Из левого желудочка с высоким давлением кровь перемещается в правый, в котором давление низкое. Врожденный порок характеризуется такими признаками: задержки развития, частые воспаления легких. При осмотре можно отметить врожденное увеличение сердечной полости, увеличение толщины стенок. Допплерография определяет сброс крови из левого желудочка в правый.
Дефект межпредсердной перегородки – стенка, расположенная между предсердиями, имеет брешь. Диагностика УЗИ позволяет увидеть утолщенные предсердия, иногда просматривается и непосредственно врожденную брешь.
Пороки митрального клапана на диагностике
Стеноз митрального клапана – порок с уменьшением щели, находящейся между левым предсердием и левым желудочком. Проявления патологии: головокружение, затрудненное дыхание, частое сердцебиение, болевые ощущения в грудной клетке. Болезнь вызывает утолщение створок клапана, стенок левого предсердия и правого желудочка.
Пролапс митрального клапана – порок с растяжением щели в пространстве левого предсердия и левого желудочка, а также пролапс – это слабое сжимание створок митрального клапана в момент систолы. Пролапс митрального клапана встречается врожденным и различается на 1 и 2 стадию пролапса. Зачастую такой пролапс заболеванием не считается и в лечении не нуждается. Эндокардит и ревматизм могут быть причиной появления пролапса. Однако пролапс в течение долгого времени никак не проявляется. Признаки митрального пролапса: одышка, вялость, болезненные ощущения от физического труда.
Эхокардиография у пациента с пролапсом митрального клапана выявляет увеличение объема стенок левых желудочка и предсердия, частичное сжатие створок митрального клапана в систоле. Использование допплерографии позволяет определить стадию пролапса.
Другие заболевания сердца на УЗИ
Инфаркт миокарда – расстройство подачи крови, что приводит к угасанию деятельности одной из его частей. УЗИ сердца пациента, перенесшего инфаркт миокарда, обнаруживает ухудшение сжатия одного из участков органа.
Экссудативный перикардит – накопление влаги в перикарде (оболочке органа). Перикардит проявляется на УЗИ обнаружением влаги, скопленной в сердечной сумке.
Миокардиты – разновидности болезней, характеризующиеся воспалительным процессом миокарда. Признаки нарушений на эхокардиографии: увеличение камер органа, уменьшение сократительной функции, снижение величины выброса левого желудочка (менее 50%).
Инфекционный эндокардит – проникновение инфекции вызывает воспаление эндокарда. Разрывы и ответвления на клапанах – признаки инфекционного эндокардита при диагностике УЗИ.
Врожденные пороки сердца редко влияют на развитие плода. Впервые это было отмечено в исследованиях B. Mac Mahon и соавт. . Однако есть пороки, не совместимые с жизнью, и после рождения ребенок тотчас погибает. Некоторые врожденные пороки сердца, даже несложные формы, в раннем неонатальном периоде протекают злокачественно, обусловливая развитие декомпенсации кровообращения и дыхательную недостаточность. Главной причиной этого является несовершенство компенсаторных механизмов.
Диагностика у плода - одна из труднейших задач перинатологии. Многие врожденные пороки сердца, даже сложные, практически не совместимые с жизнью, антенатально не проявляются в силу особенностей внутрисердечной гемодинамики и после рождения становятся катастрофой для жизни ребенка.
Антенатальный период характеризуется особенностями кровообращения, такими как высокое давление в правом желудочке, незначительный объем кровотока в легочной артерии, параллельность работы желудочков сердца, функционирующие артериальный проток и овальное окно, нагнетающие кровь как обходные анастомозы в большой круг кровообращения за счет усиленной работы правого желудочка. Эти особенности внутрисердечной гемодинамики плода, безусловно, должны корректировать характер гемодинамических изменений ультразвуковых показателей сердца в норме и при пороках сердца у плода.
Известно, что у пациентов с врожденными пороками сердца нарушения гемодинамики в результате анатомических изменений в значительной степени влияют на данные ультразвукового сканирования сердца, такие как размеры полостей сердца, степень гипертрофии миокарда, функция клапанного аппарата, сократительная способность миокарда, направленность движения межжелудочковой перегородки.
Метод оценки внутрисердечной гемодинамики базируется на широко известных понятиях о систолической, объемной и смешанной перегрузках сердца, предложенных в 1952 г. E. Cabrera и J. Monroy .
В основе разделения использован следующий принцип.
Нагрузка сопротивлением возникает при ситуации, когда выброс крови из желудочков сердца в магистральные сосуды затруднен на уровне полулунных клапанов (стеноз аорты и легочной артерии), подклапанного пространства (идиопатический гипертрофический субаортальный стеноз, подклапанный стеноз аорты или легочной артерии), на протяжении сосудистого русла (коарктация аорты) либо при значительном увеличении выходного сопротивления (синдром Эйзенменгера). В результате затруднения выброса крови резко возрастает напряжение миокарда соответствующего желудочка при относительно стабильном объеме крови, что служит проявлением систолической перегрузки сердца. При систолической перегрузке желудочков сердца независимо от нозологической формы порока полость желудочка, несущего основную нагрузку сопротивлением, умеренно увеличивается в размерах. В ответ на нагрузку сопротивлением на эхокардиограмме выявляется гипертрофия миокарда соответствующего желудочка, и чем больше сопротивление выбросу, тем резче выражена степень гипертрофии миокарда соответствующего желудочка и межжелудочковой перегородки (рис. 1) .
Рис. 1. Систолическая перегрузка правого желудочка. Поперечное сечение желудочков сердца при стенозе легочной артерии. Градиент давления правый желудочек - легочная артерия равен 200 мм рт.ст. Выраженная гипертрофия межжелудочковой перегородки и миокарда передней стенки правого желудочка.
IVS - межжелудочковая перегородка, MRV - миокарда правого желудочка, RV - правый желудочек.
Нагрузка объемом возникает при дополнительном притоке крови в желудочки и в результате шунтирования крови через септальные перегородки или артериальный проток (дефекты межпредсердной и межжелудочковой перегородок, открытый артериальный проток), а также в результате обратного тока крови через атриовентрикулярные клапаны (клапанная недостаточность).
Характерными особенностями выраженной объемной перегрузки правого желудочка являются дилатация желудочка, при которой толщина миокарда не превышает верхней границы нормы, увеличение правого предсердия, парадоксальный характер движения межжелудочковой перегородки и увеличение амплитуды движения трикуспидального клапана (рис. 2, 3).
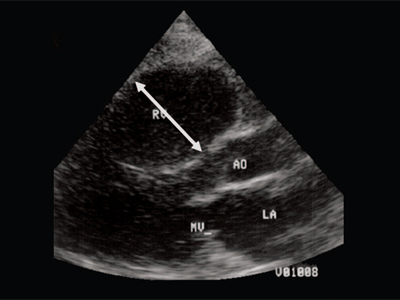
Рис. 2. Длинная ось сердца. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. Объем сброса крови превышает 200% МОС. Отмечается выраженная дилатация правого желудочка.
RV - правый желудочек, AO - аорта, LA - левое предсердие, MV - митральный клапан.
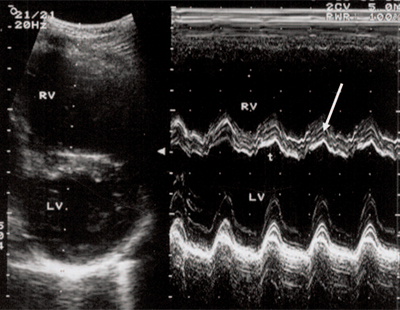
Рис. 3. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. В- и М-сканирование. Стрелкой показан парадоксальный характер движения межжелудочковой перегородки.
Для левого желудочка признаком объемной перегрузки являются увеличение полости левого предсердия и желудочка, а также экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка (рис. 4).
IVS - межжелудочковая перегородка, MLV - миокард левого желудочка, LV и RV - левый и правый желудочек.
При сочетании нагрузки сопротивлением и объемом возникает смешанная перегрузка (например, при дефекте межжелудочковой перегородки и повышении давления в легочной артерии для правого желудочка систолическая перегрузка сочетается с нагрузкой объемом, для левого желудочка в результате артериальновенозного сброса крови через дефект).
За многолетний период (с 1980 г. по настоящее время) наблюдений в ФГУ Научный центр акушерства, и перинатологии им. В.И. Кулакова Минздравсоцразвития России было замечено, что в антенатальном периоде не всегда работают принципы гемодинамических эхокардиографических проявлений врожденного порока сердца, которые ранее были разработаны и представлены в современной литературе .
Анализ более 2000 наблюдений врожденных пороков сердца у плода показал, что в ряде наблюдений имеются лишь анатомические изменения, характерные для определенной нозологической формы порока. При других врожденных пороках сердца изменения на эхокардиограмме связаны с характером гемодинамической нагрузки на сердце и аналогичны тому, что наблюдается после рождения. Наконец, в ряде наблюдений врожденных пороков сердца у плода вторичные изменения на эхокардиограмме, вызванные гемодинамическими нарушениями, отличаются от гемодинамических проявлений ультразвуковых показателей у детей и взрослых. Это позволило разделить все врожденные пороки сердца плода на три группы в зависимости от изменений на эхокардиограмме, обусловленных особенностями антенатальной внутрисердечной гемодинамики.
В первую группу вошли пороки сердца, которые, имея отчетливые анатомические проявления патологии, при ультразвуковом исследовании не имеют гемодинамических проявлений врожденного порока сердца. К ним относятся: дефект межпредсердной перегородки, дефект межжелудочковой перегородки, общий желудочек, простая форма транспозиции магистральных сосудов и также при наличии дефекта межжелудочковой перегородки общий артериальный ствол, двойное отхождение сосудов от желудочков сердца.
Следует это разобрать на примере дефекта межпредсердной перегородки. Основу расстройств внутрисердечной гемодинамики при дефекте межпредсердной перегородки составляет объемная перегрузка правых отделов сердца. При ультразвуковом исследовании у детей и взрослых это приводит к:
- дилатации правого желудочка (см. рис. 2, 3);
- увеличению правого предсердия;
- парадоксальному характеру движения межжелудочковой перегородки (см. рис. 2, 3).
Антенатально при равных величинах давления в желудочках сердца и в предсердиях объемной перегрузки не возникает. В связи с этим ни один из эхокардиографических гемодинамических признаков, используемых у детей и взрослых, не выявляется у плода. К эхокардиографическим проявлениям порока антенатально относится только прямой признак - перерыв ультразвукового луча в области дефекта. Размеры сердца, соотношение размеров желудочков сердца не отличаются от нормы (рис. 5).
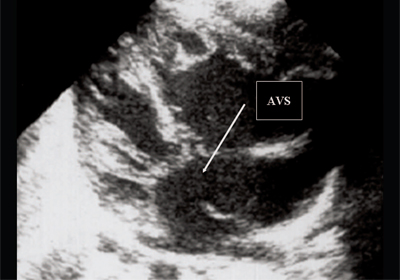
Рис. 5. Четырехкамерное сечение сердца плода. Стрелкой указан первичный дефект межпредсердной перегородки (АVS).
В равной степени это относится к дефекту межжелудочковой перегородки (рис. 6), простой форме транспозиции магистральных сосудов (рис. 7, 8), транспозиции магистральных сосудов с дефектом межжелудочковой перегородки (синдром Тауссиг - Бинга) (рис. 9), общему желудочку (рис. 10), общему артериальному стволу (рис. 10), двойному отхождению сосудов от одного из желудочков сердца (рис. 11).
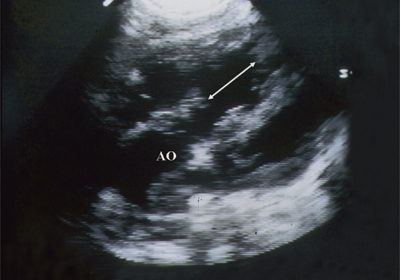
Рис. 6. Дефект межжелудочковой перегородки. Длинная ось сердца. Стрелками показан дефект межжелудочковой перегородки.
АО - аорта.
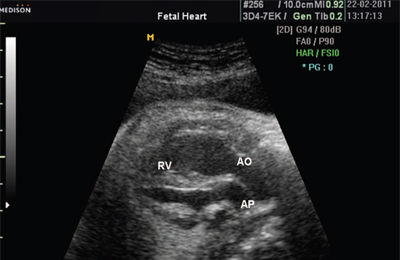
Рис. 7. Транспозиция магистральных сосудов.
АР - легочная артерия, АО - аорта, RV - правый желудочек.
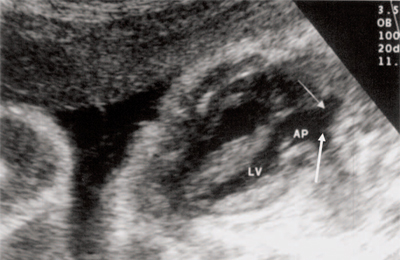
Рис. 8. Транспозиция магистральных сосудов, стрелками показаны ветви легочной артерии.
АР - легочная артерия, LV - левый желудочек.
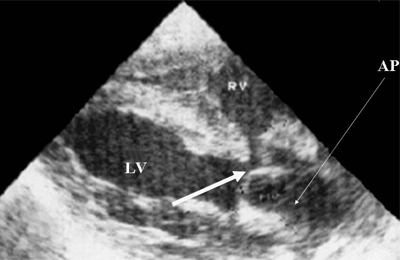
Рис. 9. Синдром Тауссиг - Бинга. Легочная артерия (отмечена стрелкой) расположена над дефектом межжелудочковой перегородки.
АР - легочная артерия, LV и RV - левый и правый желудочек.
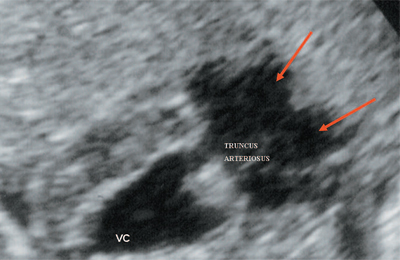
Рис. 10. Общий желудочек с отхождением TRUNCUS ARTERIOSUS. Стрелками показано разделение TRUNCUS ARTERIOSUS на аорту и ствол легочной артерии.
VC - общий желудочек, TRUNCUS ARTERIOSUS - общий артериальный ствол.
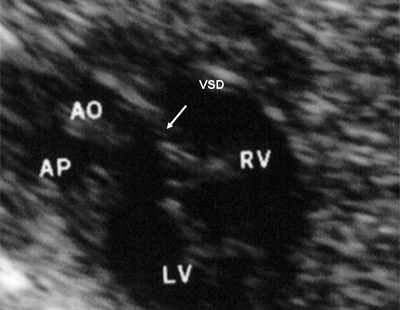
Рис. 11. Двойное отхождение магистральных сосудов от левого желудочка. Длинная ось сердца. Магистральные сосуды инвертированы и отходят от левого желудочка. Аорта расположена "верхом" над дефектом межжелудочковой перегородки (стрелка).
LV и RV - левый и правый желудочек, АР - легочная артерия, АО - аорта, VSD - дефект межжелудочковой перегородки.
Таким образом, диагностика перечисленных выше врожденных пороков сердца основывается на знании анатомических изменений, характерных для определенной нозологической формы патологии.
Вторая группа врожденных пороков сердца. При ультразвуковом исследовании регистрируются анатомические и гемодинамические изменения, характерные для определенной нозологической формы порока. В эту группу были отнесены: стеноз аорты, стеноз легочной артерии, врожденный митральный стеноз, транспозиция магистральных сосудов с сужением легочной артерии, обструкция опухолью выходного тракта одного из желудочков, аномалия Эбштейна, синдром гипоплазии правого и левого желудочков сердца, фиброэластоз, преждевременное закрытие овального окна.
Как пример можно разобрать изменения эхокардиографических показателей при клапанном стенозе легочной артерии. Нарушение гемодинамики при изолированном стенозе легочной артерии обусловлено препятствием на пути выброса крови в легочную артерию. Тяжесть стеноза определяется разницей систолического давления в правом желудочке и легочной артерии, т.е. градиентом давления.
При двухмерной выявляется утолщение створок клапана легочной артерии, экскурсия их уменьшена, а в систолу они образуют купол. Это анатомические проявления порока. К ним добавляются гемодинамические проявления: выраженная гипертрофия миокарда передней стенки правого желудочка и межжелудочковой перегородки, значительно превышающие нормативы. Степень выраженности гипертрофии миокарда правого желудочка зависит от степени стенозирования легочной артерии и соответственно от величины градиента давления. Эти данные получены при сопоставлении результатов ультразвукового сканирования и данных катетеризации полостей сердца у детей . Следует особо отметить, что при выраженной гипертрофии миокарда полость правого желудочка увеличивается незначительно. Отмечается также увеличение размера правого предсердия.
У плода получены аналогичные изменения, зависящие также от степени стенозирования легочной артерии. Полость правого желудочка, как видно на рис. 12, не увеличена. В то же время имеется значительная гипертрофия стенок правого желудочка. Как и в постнатальном периоде отмечено увеличение полости правого предсердия (рис. 13). После рождения при катетеризации полостей сердца в данном наблюдении был выявлен градиент давления на выходе из правого желудочка, равный 200 мм рт.ст.
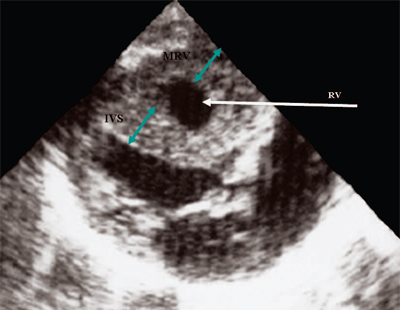
Рис. 12. Стеноз легочной артерии. Гипертрофия миокарда правого желудочка.
RV - правый желудочек, IVS - межжелудочковая перегородка, MRV - миокард правого желудочка.
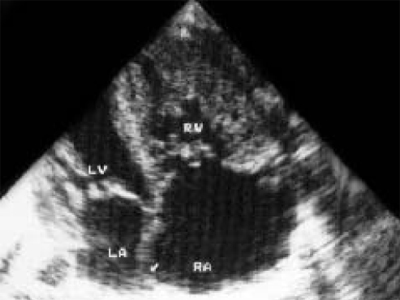
Рис. 13. Выраженный стеноз легочной артерии. Четырехкамерное сечение сердца. Значительное увеличение полости правого предсердия.
Такая взаимосвязь с нарушениями внутрисердечной гемодинамики у плода, безусловно, может быть выявлена лишь при выраженном нарушении оттока крови из правого желудочка в легочную артерию, ибо легочный кровоток в антенатальном периоде колеблется от 12 до 20%. Остальной объем крови поступает через артериальный проток в нисходящий отдел аорты. Поэтому незначительное стенозирование легочной артерии не столь информативно в плане гемодинамических ультразвуковых проявлений.
При аномалии Эбштейна антенатальная диагностика, как и в постнатальном периоде, базируется на определении области расположения трикуспидального клапана по отношению к митральному и смещении его вглубь правого желудочка. При исследовании обращают на себя внимание большие размеры сердца, преимущественно за счет правого предсердия (рис. 14). При допплеркардиографическом исследовании выявляется трикуспидальная недостаточность.
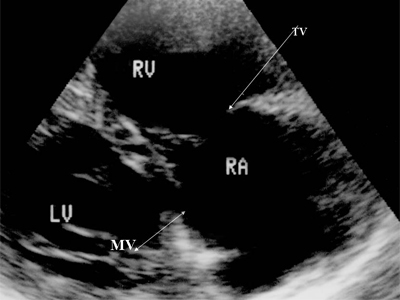
Рис. 14. Аномалия Эбштейна. Четырехкамерное сечение сердца. Отмечается смещение трикуспидального клапана к верхушке правого желудочка.
LV и RV - левый и правый желудочек, RA - правое предсердие, TV - трикуспидальный клапан, MV - митральный клапан.
Незначительное стенозирование аорты не вызывает нарушений гемодинамики у плода. При значительном препятствии выбросу крови из левого желудочка увеличивается величина давления в нем и усиливается работа левого желудочка. При выраженном стенозе значительно возрастает сопротивление выбросу крови, повышается также давление в левом предсердии и появляется лево-правый сброс крови через овальное окно в отличие от нормального для плода право-левого шунтирования. Это вызывает проявления сердечной недостаточности и может стать причиной внутриутробной задержки развития .
При ультразвуковом исследовании отмечается выраженная гипертрофия миокарда левого желудочка (рис. 15). Увеличивается размер левого предсердия. Может быть зарегистрирована митральная регургитация.
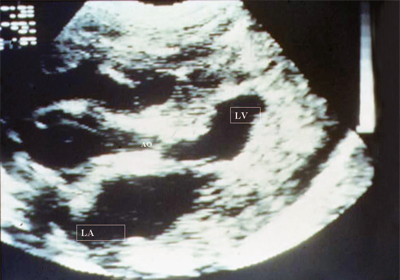
Рис. 15. Стеноз аорты. Длинная ось сердца. Отмечаются выраженное сужение аортального отверстия, выраженная гипертрофия миокарда левого желудочка, уменьшение его полости и дилатация левого предсердия.
LV - левый желудочек, LA - левое предсердие, АО - аорта.
При синдроме гипоплазии левых отделов нарушение кровообращения наступает на ранних стадиях развития плода. В отличие от нормального фетального кровообращения, когда кровь из полых вен частично проходит через овальное окно в левые отделы сердца и в большой круг кровообращения, вся кровь поступает в правый желудочек и легочный ствол. Отмечается также сброс крови из левого предсердия в правое через овальное окно . Поэтому антенатально отмечаются объемная перегрузка и дилатация правого желудочка (рис. 16). Особенностями внутрисердечной гемодинамики также объясняется то, что при цветном картировании потока выявляются ретроградный или двунаправленный кровоток через овальное отверстие и ретроградный кровоток в дистальном отделе аорты .
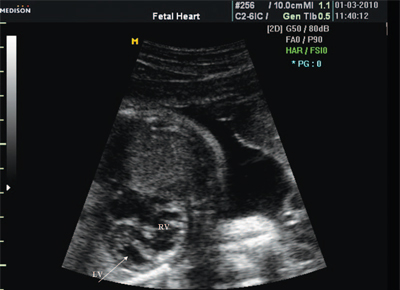
Рис. 16. Гипоплазия левого желудочка. Соотношение размеров полостей сердца изменено за счет компенсаторного увеличения размеров правого желудочка.
LV и RV - левый и правый желудочек.
Преждевременное закрытие овального окна. При антенатальном закрытии овального окна развивается правожелудочковая сердечная недостаточность и ребенок рождается обычно мертвым. Левые отделы становятся гипопластичными, миокард левого желудочка значительно гипертрофируется (рис. 17) .
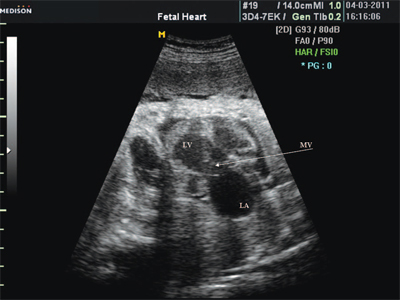
Рис. 17. Преждевременное закрытие клапана овального окна. Отмечаются умеренная гипоплазия левого желудочка, значительное увеличение левого предсердия, стрелкой показано митральное отверстие.
LV - левый желудочек, LA - левое предсердие, MV - митральный клапан.
Наконец, третья группа врожденных пороков сердца, которая по гемодинамическим изменениям эхокардиограммы антенатального периода отличается от изменений данных ультразвукового исследования в постнатальном периоде. Эта группа немногочисленна и будет подробно разобрана. В нее вошли следующие врожденные пороки сердца: атриовентрикулярный септальный дефект, тетрада Фалло, синдром Стейделя, коарктация аорты.
Атриовентрикулярный септальный дефект. При полной форме атриовентрикулярного септального дефекта все четыре камеры сообщаются между собой. Нарушения гемодинамики определяются наличием сообщений на предсердном и желудочковом уровнях и неполноценной функцией атриовентрикулярных клапанов. Нагрузка на все камеры сердца значительно увеличена.
Ультразвуковая диагностика атриовентрикулярного септального дефекта базируется на анатомических составляющих порока (выявление первичного дефекта межпредсердной перегородки; наличие высокого дефекта межжелудочковой перегородки; при полной форме наличие щели между митральным и трикуспидaльным клапаном). Имеются признаки аномалии митрального клапана, которые проявляются сближением передней створки с межжелудочковой перегородкой. Данный признак по аналогии с ангиографией носит название симптома "гусиной шеи" .
Кроме анатомических составляющих патологии, имеются изменения, связанныес гемодинамическими изменениями:
- увеличение правого предсердия;
- уменьшение размеров левого желудочка, связанное с наличием артериовенозного сброса крови, а также с часто наблюдаемой при атриовентрикулярном септальном дефекте умеренной гипоплазией левого желудочка.
Что же происходит антенатально? Кровь из верхней и нижней полых вен из правого предсердия через овальное окно поступает в левое предсердие. Поэтому увеличения правого предсердия, которое проявляется после рождения, у плода не отмечается. Имеется увеличение полости левого предсердия. Это первое отличие гемодинамических ультразвуковых признаков при атриовентрикулярном канале у плода (рис. 18).
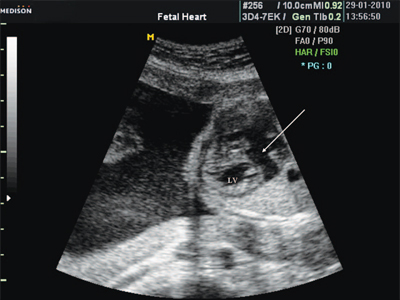
Рис. 18. Атриовентрикулярный септальный дефект (стрелка).
LV - левый желудочек.
Вторым отличием по гемодинамическим проявлениям являются увеличенные или нормальные размеры левого желудочка в отличие от уменьшенных размеров, наблюдаемых после рождения.
Тетрада Фалло. Гемодинамические изменения при тетраде Фалло обусловлены степенью препятствия выбросу крови из правого желудочка в малый круг кровообращения и наличием дефекта межжелудочковой перегородки. Величина сброса крови определяется степенью препятствия выбросу крови из правого желудочка в легочную артерию и сопротивлением большого круга кровообращения.
К анатомическим признакам патологии относятся декстропозиция аорты и дефект межжелудочковой перегородки. Отличительной особенностью при данной патологии считается увеличение диаметра аорты и инфундибулярное сужение легочной артерии. Гемодинамическим проявлением патологии следует считать гипертрофию миокарда правого желудочка при незначительном расширении его полости.
У плода также отчетливо визуализируются характерные анатомические изменения: широкая аорта, расположенная как "аорта-наездник", дефект межжелудочковой перегородки. В отличие от детей и взрослых инфундибулярный стеноз легочной артерии антенатально не выявляется. Отсутствие подклапанного сужения в раннем неонатальном периоде отмечают и патологоанатомы . Это соответствует мнению, что данная составляющая часть патологии проявляется в более зрелом возрасте и увеличивается с возрастом пациента .
Антенатально правый желудочек из-за наличия стеноза легочной артерии и дефекта межжелудочковой перегородки в работе сердца задействован меньше, чем это наблюдается в норме, когда основная нагрузка приходится именно на правые отделы сердца. Поэтому размер правого желудочка уменьшен по сравнению с нормой гестационного срока. В то же время кровообращение осуществляется за счет повышенной нагрузки на левый желудочек. Последний в результате усиленной работы гипертрофируется, начиная с 22-й недели гестации. Таким образом, для тетрады Фалло антенатально характерна гипертрофия миокарда левого желудочка (рис. 19) .
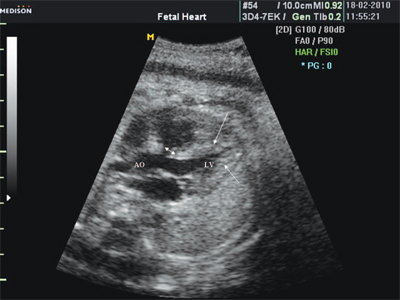
Рис. 19. Тетрада Фалло. Двойной стрелкой показан дефект межжелудочковой перегородки. Стрелками отмечена гипертрофия миокарда левого желудочка.
LV - левый желудочек, АО - аорта.
Коарктация аорты. Диагностическим основным признаком коарктации аорты является визуализация дуги и нисходящего отдела аорты с наличием анатомического ее сужения. Антенатально данный анатомический признак патологии наблюдается лишь в 30% наблюдений, так как коарктация часто формируется после рождения и закрытия артериального протока .
К гемодинамическим признакам порока у детей и взрослых относятся:
- гипертрофия миокарда левого желудочка;
- увеличение левого предсердия.
Антенатально при наличии коарктации аорты правый желудочек, активно участвующий в кровоснабжении органов плода, работает против сопротивления потоку через артериальный проток в нисходящий отдел аорты. В результате этого отмечаются увеличение полости правого желудочка и его гипертрофия. (рис. 20). Дилатируется также ствол легочной артерии. Данные ультразвуковые признаки патологии имеются в 70% наблюдений .
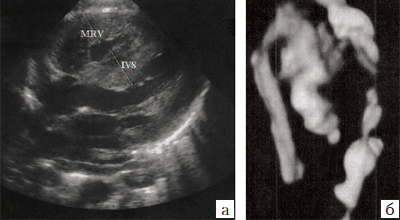
Рис. 20. Коарктация аорты (а, б). Выраженное сужение аорты в типичном месте в трехмерном изображении (б). При исследовании по длинной оси сердца отмечается выраженная гипертрофия миокарда правого желудочка.
MRV - миокард правого желудочка, IVS - межжелудочковая перегородка.
Была предложена оценка патологии по индексу отношения размера правого желудочка к размеру левого желудочка и отношения диаметра легочной артерии к диаметру аорты. В норме эти показатели соответственно равны 1,1 и 1,2.
При выраженном сужении аорты (сужение до 25% от нормальной величины) рано наблюдаются признаки сердечной недостаточности у плода, проявляющиеся наличием выпота в перикарде, значительным уменьшением размера левого желудочка и уменьшением величины сердечного выброса.
Гипоплазия левого желудочка с поражением дуг и аорты. Диагностика патологии антенатально, по мнению многих авторов, не представляет сложностей, все признаки, имеющие значение для диагностики у новорожденных и взрослых, должны быть использованы и при антенатальном исследовании.
К классическим ультразвуковым признакам синдрома гипоплазии левого желудочка относятся:
- резкое сужение восходящей дуги аорты;
- уменьшение конечно-диастолического размера левого желудочка;
- сужение диаметра аорты;
- увеличение конечно-диастолического размера правого желудочка;
- отношение конечно-диастолического размера левого желудочка к конечно-диастолическому размеру правого, равное или меньше 0,6;
- наличие грубых изменений митрального клапана.
Диагностическая задача может быть облегчена при наличии асцита, гидроперикарда у плода или при сопутствующей экстракардиальной патологии.
Выявление всех анатомических изменений при синдроме гипоплазии левого желудочка не представляет значительных трудностей. Однако имеющиеся наблюдения показали, что в некоторых случаях полость левого желудочка уменьшается незначительно, при этом имеется выраженная гипертрофия миокарда левого желудочка. Сопоставление с данными после рождения, а также с данными аутопсии показало, что такие не совсем характерные изменения при синдроме гипоплазии левого желудочка наблюдаются при наиболее тяжелой анатомической форме патологии - синдроме Стейделя (атрезии аортального клапана в сочетании с гипоплазией восходящего отдела аорты). Индекс отношения размера левого желудочка к размеру правого желудочка в диастолу находится в пределах 0,6. При гипоплазии левого желудочка без поражения дуги аорты он не превышает 0,15-0,2. При синдроме Стейделя, если имеются небольшие размеры левого желудочка, антенатально отмечается выраженная гипертрофия миокарда левого желудочка до 0,7 см (рис. 21), при синдроме гипоплазии левого желудочка без поражения дуги аорты толщина миокарда не превышает 2-3 мм .
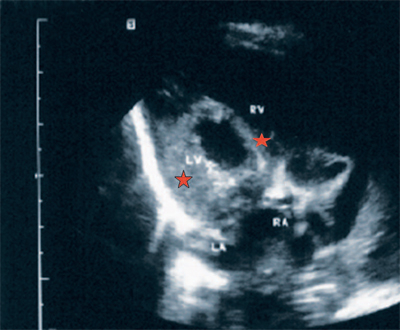
Рис. 21. Синдром Стейделя. Четырехкамерное сечение сердца. Полость левого желудочка уменьшена. Имеется выраженная гипертрофия миокарда левого желудочка и межжелудочковой перегородки. Полости правого желудочка и правого предсердия значительно увеличены в размерах.
LV и RV - левый и правый желудочек, LA и RA - левое и правое предсердие.
Таким образом, при многолетнем наблюдении пороков сердца у плода отмечены характерные особенности гемодинамических проявлений различных нозологических форм патологии. Все это с отчетливым проявлением анатомических составляющих пороков сердца может помочь в их антенатальной диагностике.
Литература
- Mac Mahon B., Mc Keown T., Record R.G. The incidence and life expectation of children with congenital heart disease // Br. Heart J. 1953. V. 15. P. 121-129
- Cabrera E., Monroy J. Systilic and Diastolic laging of the heart // Am. Heart J.1952. V. 43. N 5. P. 661.
- Затикян Е.П. Особенности внутрисердечной гемодинамики у больных врожденными пороками сердца при беременности. Дисс. ... докт. мед. наук. М., 1988.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М.: Медицина, 1989.
- Затикян Е.П. Гемодинамические закономерности изменений эхокардиограммы при врожденных пороках сердца // Кардиология. 1990. N 8. С. 47-50.
- Затикян Е.П. Врожденные и приобретенные пороки сердца у беременных. Функциональная и ультразвуковая диагностика. М.: Триада-Х, 2004.
- Allan L.D., Cook A.C., Huggon C. Fetal Echocardiography/ Cambridge University Press, 2009.
- Kleinmann C.S., Donnerstein R.L., De Vore G.R. et al. Fetal echocardiography for evalution of in utero congestive heart failure: A technique for study of nonimmune fetal hydrops // N. Engl. J. Med. 1982. V. 306. P. 568.
- Sahn D.J. Sh ndrome in utero associ ated with hydrops fetalis // Am. Heart J. 1982. V.104, N 6. P. 1368-1372.
- Norberger L.K., Sanders S.P., Rein A.J. et al. Left heart obstructive lesions and left ventricular growth in the midtrimester fetus. A longitudinale study // Circulation. 1995. V. 92. N 6. P. 1531-1538.
- Медведев М.В. Пренатальная эхография. Дифференциальный диагноз и прогноз. М.: Реал Тайм, 2009
- Nanda N., Gramiak R. Clinical Echocardiography. S. Louis, 1975.
- Zatikyan E.P. Atrioventricular septum defect in prenatal period // International Society The Fetus as a patient IX th International congress 1993. P. 41. Tokyo.
- Затикян Е.П. Атриовентрикулярный септальный дефект в пренатальном периоде // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. 1993. N 3. C. 40-45.
- Ohba T., Matsui K., Nakamura K. et al. Tеtralogy of Fallot with absent pulmonary valve detected by fetal echocardiography // Int. Gynaecol. Obstet. 1990. V. 32. N 1. P. 71-74.
- Затикян Е.П. Кардиология плода. М.: Триада-Х, 2009.
- Allan L.D.,Chita S.K, Anderson R.H. et al. Coarctation of the aorta in prenatal life: and echocardiographic, anatomical and functional study // Br. Heart J. 1988. V. 59. P. 356.
- Затикян Е.П. Эхокардиографическая оценка выраженности анатомических и гемодинамических изменений при синдроме гипоплазии левых отделов сердца: динамическое наблюдение от плода к новорожденному // Ультразвуковая диагностика. 2000. N 3. С. 29-36.
Как известно, сердце - это важный орган в теле человека, от правильной его работы зависит благополучие всего организма. Сердце состоит из мышечной (миокард) и соединительной ткани (сердечные клапаны, стенки крупных сосудов). Деятельность сердца обусловлена ритмичным и последовательным сокращением составляющих его структур (предсердия и желудочки), в результате чего кровь, протекая через легкие, насыщается кислородом (так называемый малый круг кровообращения) и разносит кислород по всем органам и тканям (большой круг кровообращения).
Когда сердце плода развивается во время беременности, его работа отличается от работы сердца новорожденного ребенка и взрослого человека. В частности, малый круг кровообращения полноценно начинает функционировать только во время родов, когда происходит раскрытие легких новорожденного, и в момент первого крика они наполняются кровью. Поэтому в сердце плода существуют специальные отверстия и протоки, позволяющие циркулировать крови в формирующемся организме в обход легких (артериальный проток, соединяющий аорту и легочную артерию, овальное окно между предсердиями, венозный проток между пупочной веной и нижней полой веной).
Иногда под действием неблагоприятных факторов в период внутриутробного развития происходят грубые нарушения формирования анатомических структур сердца, что сказывается на его деятельности и не всегда совместимо с жизнью ребенка. Тогда либо по УЗИ плода во время беременности, либо в первые дни после родов новорожденному устанавливается диагноз врожденного порока развития сердца . Что это такое, каков прогноз для жизни и какие методы сохранения жизни и здоровья таких малышей предлагает современная медицина, мы и попробуем выяснить в данной статье.
Итак, эти патологические состояния представляют собой многочисленную группу заболеваний сердца, объединенных следующими признаками:
Возникают в период внутриутробного развития;
- характеризуются грубейшими нарушениями архитектоники сердца и крупных сосудов (аорта, нижняя и полая вена, легочные артерия и вены);
- анатомические изменения вызывают значительные нарушения в гемодинамике (циркуляции крови по организму);
- обусловлены недоразвитием анатомических структур или переменой их нормального расположения в сердце.
Частота распространенности варьирует от 6 до 9 на 1000 живых новорожденных. По данным разных авторов, возможных вариантов врожденных пороков развития сердца насчитывается от 50 до 100.
Схематичное изображение некоторых пороков сердца
Причины врожденных пороков сердца
В связи с тем, что во время внутриутробного развития происходит активное формирование всех органов человеческого организма, особенно сердца, плод и беременная женщина уязвимы к действию различных негативных факторов. Так, влияние на неправильное течение органогенеза могут оказать повышенный радиационный фон, ионизирующее излучение, инфекционные заболевания матери, особенно вирусные – краснуха, корь, ветрянка, герпес; прием некоторых лекарственных и токсических веществ (наркотиков, алкоголя) в период беременности, особенно в первом триместре (8 -12 –я недели – период наиболее интенсивного формирования всех органов плода). В 4 – 10% случаев врожденные пороки генетически обусловлены, то есть передаются по наследству.
Симптомы врожденных пороков сердца
Клиническая симптоматика пороков зависит от их вида. Выделяют пороки «синего» и «белого» типов, а также пороки, создающие препятствие кровотоку.
Основным проявлением «синих» пороков (транспозиция (перемена расположения) магистральных артерий, тетрада Фалло, атрезия – заращение - трикуспидального клапана) является цианоз – синее окрашивание кожи пальцев, кистей, стоп, носогубного треугольника, ушей, носа или, в крайне тяжелых случаях, всего тела. Также проявлением артериальной гипоксемии (пониженного содержания кислорода) являются одышка, потеря сознания с судорогами или без, тахикардия (учащенное сердцебиение), отставание в росте и развитии, частые простудные заболевания, неврологическая симптоматика в связи с отсутствием нормального кровоснабжения головного мозга. Как правило, пороки этого типа проявляют себя уже в первые часы и дни жизни новорожденного ребенка. Транспозиция магистральных артерий (полые вены входят в левое, а не правое предсердие, а аорта отходит от правого, а не левого желудочка) является тяжелым пороком, несовместимым с жизнью, и ребенок, как правило, погибает сразу после родов. Также к несовместимым с жизнью порокам относится трехкамерное сердце (два предсердия и один желудочек, или одно предсердие и два желудочка). Летальность пороков данного типа очень высока, если дети с такими пороками выживают в первые дни жизни, то без лечения погибают к концу первого – второго года.
К порокам белого типа
относятся дефект межжелудочковой перегородки, открытый Боталлов (артериальный) проток, дефект межпредсердной перегородки. Клинически эти пороки могут начать проявлять себя не в период раннего, детства, а к 16 – 20 годам. Симптомы пороков белого типа следующие: бледность кожных покровов, отставание в развитии, частые ОРВИ, признаки развивающейся правожелудочковой недостаточности – одышка и тахикардия при физической нагрузке или в покое.
Пороки с препятствием кровотоку: стеноз (сужение просвета) аорты, коарктация (сегментарное сужение) аорты, стеноз легочной артерии клинически проявляются одышкой, тахикардией, болями в грудной клетке, снижением выносливости, отеками, отставанием в развитии и нарушением кровообращения нижней половины туловища. При коарктации аорты дети доживают максимум до 2 –летнего возраста.
Диагностика врожденных пороков развития сердца
Как правило, диагностировать пороки развития плода, в том числе и сердца, возможно еще на этапе ультразвукового обследования беременной женщины. Тогда, в зависимости от вида порока, женщине может быть рекомендовано либо прерывание беременности (при пороках, не совместимых с жизнью, при множественных уродствах и т. д.), либо сохранение беременности с более детальным обследованием беременной и решением вопроса об оперативном лечении ребенка сразу или через некоторое время после родов. Но иногда в силу некоторых причин (не посещение беременной женской консультации и УЗИ кабинета, недостаточное оснащение фельдшерско-акушерских пунктов УЗИ аппаратурой и т. д.) пороки развития могут быть диагностированы только после родов.
Несмотря на то, что симптомы врожденных пороков достаточно яркие, в процессе клинического осмотра новорожденного ребенка диагноз можно только предположить, так как многие симптомы не являются строго специфичными, а могут быть обусловлены другими тяжелыми состояниями новорожденных (респираторный дистресс синдром, внутричерепные кровоизлияния и т. д.). Также не все пороки могут давать характерную аускультативную картину (в процессе выслушивания грудной клетки), и наоборот, шумы, щелчки или иные аускультативные проявления могут встречаться при незначительных отклонениях от нормы в строении сердца (малые аномалии). Поэтому, если порок сердца не был диагностирован по УЗИ плода, всем деткам с симптомами нарушения кровообращения (диффузный или акроцианоз, одышка при кормлении или в покое, потеря сознания, судороги), должно быть произведено УЗИ сердца во время пребывания в роддоме.
Эхокардиография (УЗИ сердца) это один из самых информативных методов визуализации пороков сердца. Также могут быть назначены ЭКГ (покажет нарушения ритма, гипертрофию предсердий и/или желудочков, если таковые имеются), рентгенография грудной клетки (покажет застой крови в легких, если есть, увеличение тени сердца в связи с расширением его камер). В особо сложных случаях или перед оперативным лечением могут быть назначены вентрикулография (введение рентгенконтрастного вещества в полость желудочков сердца), ангиография (введение контраста через сосуды в полости сердца), зондирование камер сердца с измерением в них давления.
Теперь остановимся подробнее на ультразвуковой диагностике часто встречающихся пороков сердца.
А. Врожденные порки сердца с объемной перегрузкой сосудов в легких (малого круга кровообращения).
1. Дефект межпредсердной перегородки - с помощью одномерной эхокардиографии выявляются признаки объемной перегрузки и дилатации (расширения) правого желудочка, при двухмерной эхокардиографии виден обрыв эхосигнала между предсердиями, а при допплер исследовании оценивается турбулентный (с «завихрениями») поток крови через межпредсердную перегородку и степень нарушений легочного кровотока.
2. Дефект межжелудочковой перегородки - при проведении УЗИ сердца визуализируются отверстие в перегородке между желудочками, дилатация левого и правого желудочков, турбулентный кровоток из левого в правый желудочек, оценивается степень тяжести легочной гипертензии, измеряется разница давления в желудочках.
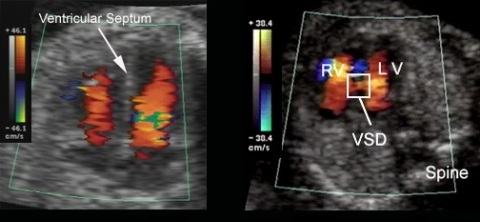
Так проявляется дефект перегородки между желудочками при проведении эхокардиографии с допплером. Слева - нормальная межжелудочковая перегородка, справа - ее дефект (VSD).
3. Открытый Боталлов проток – проявляется на эхокардиографии непрерывным кровотоком посредством сообщения в аорте и легочной артерии, изменением кровотока в устье легочного ствола.
4. Коарктация аорты – виден сегментарный участок сужения просвета аорты, ускоренный поток крови ниже сегмента.
5. Транспозиция магистральных артерий – визуализируется неправильное отхождение сосудов от сердца.
Б. Пороки сердца с уменьшением объема крови в малом круге кровообращения.
1. Тетрада Фалло – при эхокардиографии помимо стеноза (сужения) легочной артерии и дефекта перегородки между желудочками, определяется гипертрофия правого желудочка и отхождение аорты из правого желудочка, также оценивается степень нарушения внутрисердечной гемодинамики.
2. Стеноз легочной артерии – выявляется сужение просвета легочной артерии, и ускорение кровотока в устье легочной артерии и гипертрофия правого желудочка.
3. Аномалия Эпштейна – патология развития трехстворчатого клапана сердца, когда створки клапана прикрепляются не к фиброзному кольцу между предсердием и желудочком справа, а к стенкам правого желудочка, что вызывает уменьшение его объема. При ЭХО – КГ определяется патология клапана, оценивается степень расширения полостей сердца и нарушения внутрисердечного тока крови.
4. Атрезия трикуспидального клапана – при ЭХО – КГ отсутствует отражение эхосигнала от трикуспидального клапана, регистрируется гипертрофия правого предсердия и левого желудочка.
В. Пороки сердца с уменьшением объема циркулирующей крови в большом круге кровообращения (в сосудах всех жизненно важных органов).
1. Коарктация аорты (см. выше).
2. Изолированный стеноз аорты – оценивается степень сужения, визуализируется ускоренный кровоток через аортальный клапан и деформированные створки клапана.
Г. Пороки сердца без нарушения гемодинамики.
- Декстрокардия (зеркальное расположение сердца справа) – достаточно редкая аномалия, по УЗИ сердца нарушений гемодинамики, как правило, не регистрируется.
Лечение врожденных пороков развития сердца
Полное излечение подавляющего большинства пороков сердца возможно только с помощью их хирургической коррекции. Кардиохирургические операции могут быть проведены в первые часы или дни жизни новорожденного, либо на первом году жизни ребенка. При открытом артериальном протоке допустима выжидательная тактика (при отсутствии симптомов жизнеугрожающих состояний), так как этот проток может самостоятельно закрываться в первые два года жизни.
Операции могут выполняться как на открытом сердце (с рассечением стенки грудной клетки), так и кардиоваскулярным методом (когда доступ к сердцу осуществляется посредством введения в сосуды зонда, достигающего полостей сердца). Последний метод, например, применяется при коррекции дефектов между предсердиями или желудочками, к которым с помощью зонда подводится окклюдер, закрывающий отверстия.
Но при некоторых пороках сердца, не совместимых с жизнью, например, трехкамерное сердце (одно предсердие и два желудочка, или два предсердия и один желудочек) проведение хирургической коррекции, к сожалению, не возможно.
Кроме кардиохирургической операции, пациенту назначается медикаментозная терапия для улучшения сократительной функции сердца и «разгрузки» малого круга кровообращения. Применяются ингибиторы АПФ (эналаприл, периндоприл, лизиноприл, рамиприл и др), диуретики (фуросемид, индапамид и др), В-адреноблокаторы (карведилол, бисопролол и др).
Образ жизни с врожденным пороком сердца
Пациенту необходимо соблюдать следующие рекомендации относительно его образа жизни:
- рациональное сбалансированное питание;
- соблюдение диеты с ограничением поваренной соли и объема потребляемой жидкости (для уменьшения объемной перегрузки сердца и сосудов);
- достаточное пребывание на свежем воздухе;
- исключение любых занятий спортом и ограничение сильных физических нагрузок;
- достаточный по продолжительности сон;
- регулярное наблюдение у кардиолога и кардиохирурга с проведением необходимых лечебно-диагностических мероприятий;
- беременность женщинам с пороками «синего» типа строго противопоказана, но если было проведено хирургическое лечение, то возможность сохранения беременности определяется в каждом конкретном случае индивидуально с совместным ведением беременной кардиохирургом, кардиологом и акушер-гинекологом в специализированном стационаре. Родоразрешение, как правило, проводится путем кесарева сечения.
Прогноз при врожденных пороках сердца
Прогноз для жизни большинства пороков сердца неблагоприятный. Как уже было сказано выше, кардиохирургическое лечение таким деткам требуется в первые дни и месяцы после родов, иначе они погибают в течение первых двух лет из–за прогрессирования сердечной недостаточности или присоединения осложнений (бактериальный эндокардит, фатальные нарушения ритма, повышенный риск тромбообразования и тромбоэмболических осложнений, частые заболевания бронхолегочной системы (затяжные бронхиты, тяжелые пневмонии). Исключение составляют пороки белого типа, при которых в случае отсутствия хирургического лечения в силу каких либо причин дети способны доживать до 16 – 18 лет.
После хирургической коррекции прогноз для жизни благоприятный, но все равно состояние ребенка остается достаточно серьезным, поэтому за такими детьми должно осуществляться усиленное наблюдение родителей и врачей.
В заключение хотелось бы отметить, что данный диагноз у ребенка на современном этапе развития медицины не является приговором, так как возможности отечественной и зарубежной кардиологии детского возраста позволяют выносить, родить и вырастить малыша, способного вести полноценный образ жизни, несмотря на столь тяжелое заболевание.
Врач терапевт Сазыкина О.Ю.



