Константы химического равновесия. Химическое равновесие: константа химического равновесия и способы ее выражения
Вернемся к процессу производства аммиака, выражающемуся уравнением:
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
Находясь в закрытом объеме, азот и водород соединяются и образуют аммиак. До каких пор будет протекать этот процесс? Логично предположить, что до тех пор, пока какой-либо из реагентов не закончится. Однако, в реальной жизни это не совсем так. Дело в том, что через некоторое время после того, как началась реакция, образовавшийся аммиак станет разлагаться на азот и водород, т.е., начнется обратная реакция:
2NH 3 (г) → N 2 (г) + 3H 2 (г)
Фактически в закрытом объеме будут протекать сразу две, прямо противоположные друг другу, реакции. Поэтому, данный процесс записывается таким уравнением:
N 2 (г) + 3H 2 (г) ↔ 2NH 3 (г)
Двойная стрелка указывает на то, что реакция идет в двух направлениях. Реакция соединения азота и водорода называется прямой реакцией . Реакция разложения аммиака - обратной реакцией .
В самом начале процесса скорость прямой реакции очень велика. Но с течением времени концентрации реагентов уменьшаются, а количество аммиака возрастает - как следствие скорость прямой реакции уменьшается, а скорость обратной - возрастает. Наступает время, когда скорости прямой и обратной реакций сравниваются - наступает химическое равновесие или динамическое равновесие. При равновесии протекает как прямая, так и обратная реакции, но их скорости одинаковы, поэтому изменений не заметно.
Константа равновесия
Разные реакции протекают по-разному. В одних реакциях до момента наступления равновесия образуется довольно большое количество продуктов реакции; в других - гораздо меньше. Т.о., можно сказать, что конкретное уравнение имеет свою константу равновесия. Зная константу равновесия реакции, можно определить относительное количество реагентов и продуктов реакции, при котором наступает химическое равновесие.
Пусть некоторая реакция описывается уравнением: aA + bB = cC + dD
- a, b, c, d - коэффициенты уравнения реакции;
- A, B, C, D - химические формулы веществ.
Константа равновесия:
[C] c [D] d K = ———————— [A] a [B] b
Квадратные скобки показывают, что в формуле участвуют молярные концентрации веществ.
О чем говорит константа равновесия?
Для синтеза аммиака при комнатной температуре К=3,5·10 8 . Это довольно большое число, свидетельствующее о том, что химическое равновесие наступит когда концентрация аммиака будет намного больше оставшихся исходных веществ.
При реальном производстве аммиака задача технолога состоит в том, чтобы получить как можно бОльший коэффициент равновесия, т.е., чтобы прямая реакция прошла до конца. Каким образом этого можно добиться?
Принцип Ле Шателье
Принцип Ле Шателье гласит:
Как это понять? Все очень просто. Нарушить равновесие можно тремя способами:
- изменив концентрацию вещества;
- изменив температуру;
- изменив давление.
Когда реакция синтеза аммиака находится в равновесии, то это можно изобразить так (реакция экзотермическая):
N 2 (г) + 3H 2 (г) → 2NH 3 (г) + Теплота
Меняем концентрацию
Введем дополнительное количество азота в сбалансированную систему. При этом баланс нарушится:

Прямая реакция начнет протекать быстрее, поскольку количество азота увеличилось и он вступает в реакцию в большем количестве. Через некоторое время снова наступит химическое равновесие, но при этом концентрация азота будет больше, чем концентрация водрода:

Но, осуществить "перекос" системы в левую часть можно и другим способом - "облегчив" правую часть, например, отводить аммиак из системы по мере его образования. Т.о., снова будет преобладать прямая реакция образования аммиака.
Меняем температуру
Правую сторону наших "весов" можно изменять путем изменения температуры. Для того, чтобы левая часть "перевесила", необходимо "облегчить" правую часть - уменьшить температуру:

Меняем давление
Нарушить равновесие в системе при помощи давления можно только в реакциях с газами. Увеличить давление можно двумя способами:
- уменьшением объема системы;
- введением инертного газа.
При увеличении давления количество столкновений молекул возрастает. При этом повышается концентрация газов в системе и изменяются скорости прямой и обратной реакций - равновесие нарушается. Чтобы восстановить равновесие система "пытается" уменьшить давление.
Во время синтеза аммиака из 4-х молекул азота и водорода образуется две молекулы аммиака. В итоге количество молекул газов уменьшается - давление падает. Как следствие, чтобы придти к равновесию после увеличения давления, скорость прямой реакции возрастает.
Подведем итог. Согласно принципу Ле Шателье увеличить производство аммиака можно:
- увеличивая концентрацию реагентов;
- уменьшая концентрацию продуктов реакции;
- уменьшая температуру реакции;
- увеличивая давление при котором происходит реакция.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X =  и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14), 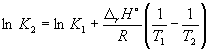 =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия , которая может быть выражена через равновесные концентрации С i , парциальные давления P i или мольные доли X i реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:



Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. На основании уравнения состояния идеального газа, записанного в виде соотношения P i = C i RT, где С i = n i /V, и закона Дальтона для идеальной газовой смеси, выраженного уравнением P = ΣP i , можно вывести соотношения между парциальным давлением P i , молярной концентрацией С i и мольной долей X i i-го компонента:
![]()
Отсюда получаем соотношение между K c , K p и K x:
![]()
Здесь Δν – изменение числа молей газообразных веществ в течение реакции:
Δν = – ν 1 – ν 2 – ... + ν" 1 + ν" 2 + ...
Величина константы равновесия K x , в отличие от констант равновесия K c и K p , зависит от общего давления Р.
Выражение для константы равновесия элементарной обратимой реакции может быть выведено из кинетических представлений. Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества. Скорость прямой реакции V 1 в этот момент максимальна, а скорость обратной V 2 равна нулю:
![]()
![]()
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв, что V 1 = V 2 , можно записать:

Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л. Приведённый вывод выражения для константы равновесия, однако, исходит из ложной в общем случае посылки, что скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Как известно, в общем случае показатели степени при концентрациях реагентов в кинетическом уравнении химической реакции не совпадают со стехиометрическими коэффициентами.
11. Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
Окислительно-восстановительными называют процессы, которые, сопровождаются смещением электронов от одних свободных или связанных атомов к другим. Поскольку в таких случаях имеет значение не степень смещения, а только число смещенных электронов, то принято условно считать смещение всегда полным и говорить об отдаче или смещении электронов.
Если атом или ион элемента отдает или принимает электроны, то в первом случае степень окисления элемента повышается, и он переходит в окисленную форму (ОФ), а во втором – понижается, и элемент переходит в восстановленную форму (ВФ). Обе формы составляют сопряженную окислительно-восстановительную пару. В каждой окислительно-восстановительной реакции участвуют две сопряженные пары. Одна из них соответствует переходу окислителя, принимающего электроны, в его восстановленную форму (ОФ 1 →ВФ 1), а другая – переходу восстановителя, отдающего электроны, в его окисленную форму (ВФ 2 →ОФ 2), например:
Cl 2 + 2 I – → 2 Cl – + I 2
ОФ 1 ВФ 1 ВФ 2 ОФ 2
(здесь Cl 2 – окислитель, I – – восстановитель)
Таким образом, одна и та же реакция всегда является одновременно процессом окисления восстановителя и процессом восстановления окислителя.
Коэффициенты в уравнениях окислительно-восстановительных реакций могут быть найдены методами электронного баланса и электронно-ионного баланса. В первом случае число принятых или отданных электронов определяется по разности степеней окисления элементов в исходном и конечном состояниях. Пример:
HN 5+ O 3 + H 2 S 2– → N 2+ O + S + H 2 O
В этой реакции степень окисления меняют два элемента: азот и сера. Уравнения электронного баланса:
Доля диссоциированных молекул H 2 S незначительна, поэтому в уравнение подставляется не ион S 2– , а молекула H 2 S. Вначале уравнивается баланс частиц. При этом в кислой среде для уравнивания используются ионы водорода, добавляемые к окисленной форме, и молекулы воды, добавляемые к восстановленной форме. Затем уравнивается баланс зарядов, и справа от черты указываются коэффициенты, уравнивающие количество отданных и принятых электронов. После этого внизу записывается суммарное уравнение с учетом коэффициентов:
Получили сокращенное ионно-молекулярное уравнение. Добавив к нему ионы Na + и K + , получим аналогичное уравнение в полной форме, а также молекулярное уравнение:
NaNO 2 + 2 KMnO 4 + 2 KOH → NaNO 3 + 2 K 2 MnO 4 + H 2 O
В нейтральной среде баланс частиц уравнивается путем добавления молекул воды в левую часть полуреакций, а в правую часть добавляются ионы H + или OH – :
I 2 + Cl 2 + H 2 O → HIO 3 + HCl
Исходные вещества не являются кислотами или основаниями, поэтому в начальный период протекания реакции среда в растворе близка к нейтральной. Уравнения полуреакций:
| I 2 + 6 H 2 O + 10e → 2 IO 3 – + 12 H + | |
| Cl 2 + 2e → 2 Cl – | |
| I 2 + 5 Cl 2 + 6 H 2 O → 2 IO 3 – + 12 H + + 10 Cl – |
Уравнение реакции в молекулярной форме:
I 2 + 5 Cl 2 + 6 H 2 O → 2 HIO 3 + 10 HCl.
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления *. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителяили восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO 3 , H 2 SO 4 ,HClO 4 , KMnO 4 , K 2 Cr 2 O 7 и др.) или только восстановителями (NH 3 , H 2 S, галогеноводороды, Na 2 S 2 O 3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H 2 O 2 , H 2 SO 3 и др.).
Окислительно-восстановительные реакции разделяются на три основных типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К первому типу относятся процессы, в которых атомы элемента-окислителя и элемента-восстановителя входят в состав разных молекул.
Внутримолекулярными называются реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы. Например, термическое разложение хлората калия по уравнению:
2 KClO 3 → 2 KCl + 3 O 2
Реакциями диспропорционирования называют процессы, в которых окислителем и восстановителем является один и тот же элемент в одной и той же степени окисления, которая в реакции одновременно как снижается, так и повышается, например:
3 HClO → HClO 3 + 2 HCl
Возможны также реакции обратного диспропорционирования. К ним относятся внутримолекулярные процессы, в которых окислителем и восстановителем является один и тот же элемент, но в виде атомов, находящихся в разной степени окисления и выравнивающих ее в результате реакции, например.
Константа химического равновесия
Все химические реакции можно разделить на 2 группы: реакции необратимые, т.е. протекающие до полного израсходования одного из реагирующих веществ, и реакции обратимые, в которых ни одно из реагирующих веществ не расходуется полностью. Это связано с тем, что необратимая реакция протекает только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлении. Например, реакция
Zn + H 2 SO 4 ® ZnSO 4 + H 2
протекает до полного исчезновения либо серной кислоты, либо цинка и не протекает в обратном направлении: металлический цинк и серную кислоту невозможно получить, пропуская водород в водный раствор сульфата цинка. Следовательно, эта реакция необратимая.
Классическим примером обратимой реакции может служить реакция синтеза аммиака из азота и водорода: N 2 + 3 H 2 ⇆ 2 NH 3 .
Если при высокой температуре смешать 1 моль азота и 3 моль водорода, то даже после достаточно длительного промежутка времени протекания реакции в реакторе будут присутствовать не только продукт реакции (NH 3), но и непрореагировавшие исходные вещества (N 2 и H 2). Если в реактор при тех же условиях ввести не смесь азота и водорода, а чистый аммиак, то через некоторое время окажется, что часть аммиака разложилась на азот и водород, т.е. реакция протекает в обратном направлении.
Для понимания природы химического равновесия необходимо рассмотреть вопрос о скоростях прямой и обратной реакций. Под скоростью химической реакции понимают изменение концентрации исходного вещества или продукта реакции за единицу времени. При изучении вопросов химического равновесия концентрации веществ выражают в моль/л; эти концентрации показывают, сколько моль данного реагирующего вещества содержится в 1 литре сосуда. Например, утверждение «концентрация аммиака равна 3 моль/л» означает, что в каждом литре рассматриваемого объёма содержится 3 моль аммиака.
Химические реакции осуществляются в результате столкновений между молекулами, поэтому, чем больше молекул находится в единице объёма, тем чаще происходят столкновения между ними, и тем больше скорость реакции. Таким образом, чем больше концентрации реагирующих веществ, тем больше скорость реакции.
равновесия в системе не наблюда-
ется никаких видимых изменений.
Так, например, концентрации всех веществ могут сколь угодно долго оставаться неизменными, если на систему не оказывать внешнего воздействия. Это постоянство концентраций в системе, находящейся в состоянии химического равновесия, совсем не означает отсутствия взаимодействия и объясняется тем, что прямая и обратная реакции протекают с одинаковой скоростью. Такое состояние также называют истинным химическим равновесием. Таким образом, истинное химическое равновесие является динамическим равновесием.
От истинного равновесия следует отличать равновесие ложное. Постоянство параметров системы (концентраций веществ, давления, температуры) является необходимым, но недостаточным признаком истинного химического равновесия. Это можно пояснить следующим примером. Взаимодействие азота и водорода с образованием аммиака, как и разложение аммиака, протекает с заметной скоростью при высокой температуре (около 500 °С). Если при комнатной температуре смешивать в любых соотношениях водород, азот и аммиак, то реакция N 2 + 3 H 2 ⇆ 2 NH 3
протекать не будет, и все параметры системы будут сохранять постоянное значение. Однако в данном случае равновесие является ложным, а не истинным, т.к. оно не является динамическим; в системе отсутствует химическое взаимодействие: скорость как прямой, так и обратной реакции равна нулю.
При дальнейшем изложении материала термин «химическое равновесие» будет использоваться применительно к истинному химическому равновесию.
Количественной характеристикой системы в состоянии химического равновесия является константа равновесия K .
Для общего случая обратимой реакции a A + b B + ... ⇆ p P + q Q + ...
Константа равновесия выражается следующей формулой:
В формуле 5.1 С(А), С(B), С(P) С(Q) – равновесные концентрации (моль/л) всех веществ-участников реакции, т.е. концентрации, которые устанавливаются в системе в момент химического равновесия; a, b, p, q – стехиометрические коэффициенты в уравнении реакции.
Выражение константы равновесия для реакции синтеза аммиака N 2 +3H 2 ⇆2NH 3 имеет следующий вид: . (5.2)
Таким образом, численная величина константы химического равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, причём концентрация каждого вещества должна быть возведена в степень, равную стехиометрическому коэффициенту в уравнении реакции.
Важно понимать, что константа равновесия выражается через равновесные концентрации, но не зависит от них ; напротив, соотношение равновесных концентраций участвующих в реакции веществ будет таким, чтобы соответствовать константе равновесия. Константа равновесия зависит от природы реагирующих веществ и температуры и представляет собой постоянную (при постоянной температуре) величину .
Если K >> 1, то числитель дроби выражения константы равновесия во много раз превышает знаменатель, следовательно, в момент равновесия в системе преобладают продукты реакции, т.е. реакция в значительной мере протекает в прямом направлении.
Если K << 1, то знаменатель во много раз превышает числитель, следовательно, в момент равновесия в системе преобладают исходные вещества, т.е. реакция лишь в незначительной степени протекает в прямом направлении.
Если К ≈ 1, то равновесные концентрации исходных веществ и продуктов реакции сопоставимы; реакция в заметной степени протекает как в прямом, так и в обратном направлении.
Следует иметь в виду, что в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой фазе или в растворённом состоянии (если реакция протекает в растворе). Если в реакции участвует твёрдое вещество, то взаимодействие происходит на его поверхности, поэтому концентрация твёрдого вещества принимается постоянной и не записывается в выражение константы равновесия.
CO 2 (газ) + C (тв.) ⇆ 2 CO (газ)
CaCO 3 (тв.) ⇆ CaO (тв.) + CO 2 (газ) K = C(CO 2)
Ca 3 (PO 4) 2 (тв.) ⇆ 3Ca 2+ (раствор) + 2PO 4 3– (раствор) K = C 3 (Ca 2+)·C 2 (PO 4 3–)
Константа химического равновесия
Большинство химических реакций обратимы, т.е. протекают одновременно в противоположных направлениях. В тех случаях, когда прямая и обратная реакции идут с одинаковой скоростью, наступает химическое равновесие. Например, в обратимой гомогенной реакции: H 2 (г) + I 2 (г) ↔ 2HI(г) соотношение скоростей прямой и обратной реакций согласно закону действующих масс зависит от соотношения концентраций реагирующих веществ, а именно: скорость прямой реакции: υ 1 = k 1 [Н 2 ]. Скорость обратной реакции: υ 2 = k 2 2 .
Если H 2 и I 2 – исходные вещества, то в первый момент скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции равна нулю. По мере израсходования H 2 и I 2 и образования HI скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Спустя некоторое время обе скорости уравниваются, и в системе устанавливается химическое равновесие, т.е. число образующихся и расходуемых молекул HI в единицу времени становится одинаковым.
Так как при химическом равновесии скорости прямой и обратной реакций равны V 1 = V 2 , то k 1 = k 2 2 .
Поскольку k 1 и k 2 при данной температуре постоянны, то их отношение будет постоянным. Обозначая его через K, получим:

К – называется константой химического равновесия, а приведенное уравнение – законом действующих масс (Гульдберга - Ваале).
В общем случае для реакции вида аА+bB+…↔dD+eE+… константа равновесия равна ![]() . Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции
. Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции  .
.
Состояние равновесия характеризует тот предел, до которого в данных условиях реакция протекает самопроизвольно (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Соотношение между равновесными концентрациями не зависит от того, какие вещества берутся в качестве исходных (например, H 2 и I 2 или HI), т.е. к состоянию равновесия можно подойти с обеих сторон.
Константа химического равновесия зависит от природы реагентов и от температуры; от давления (если оно слишком высокое) и от концентрации реагентов константа равновесия не зависит.
Влияние на константу равновесия температуры, энтальпийного и энтропийного факторов . Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала химической реакции ∆G o простым уравнением ∆G o =-RT ln K.
Из него видно, что большим отрицательным значениям ∆G o (∆G o <<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), то в равновесной смеси преобладают исходные вещества. Указанное уравнение позволяет по величине ∆G o вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если учесть, что ∆G o =∆Н o -Т∆S o , то после некоторого преобразования получим ![]() . Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
. Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.



